임상용 제품 생산지연 변수ㆍ완전무결 생산기지 구축해야 상업화 가능..한미 "생산 최적화 단계"
한미약품이 초대형 기술수출로 각광을 받았지만 안정적인 신약 공급을 위한 생산시설 구축이라는 새로운 도전에 직면했다. 한미약품 기술수출 성과의 핵심기술인 ‘랩스커버리’ 적용 바이오 공장을 완벽하게 구축하지 않으면 신약 성과가 물거품 될 수 있다는 위기론도 불거진다.
한미약품 랩스커버리 약물 생산지연으로 임상 차질..대량생산 문제 노출 가능성
9일 한미약품에 따르면 얀센의 당뇨비만치료제 ‘JNJ-64565111’ 의 환자 모집 유예(Suspended participant recruitment) 이유가 ‘생산 지연’으로 확인됐다. 얀센은 제약바이오 전문 매체 엔드포인츠뉴스(ENDPOINTS NEWS)를 통해 한미약품의 ‘생산과 관련된 지연’(manufacturing-related delay)을 환자 모집 중단의 이유로 제시했다.
JNJ-64565111은 한미약품이 지난해 11월 얀센에 기술수출한 당뇨비만치료제다. 한미약품은 임상1상시험을 완료한 후 계약금 1억500만달러(약 1200억원)를 받고 기술 수출했고, 얀센은 지난 7월부터 추가 임상1상시험을 진행 중이다.
지난달 30일 미국 임상정보사이트 ‘ClinicalTrials’에 얀센이 'JNJ-64565111'의 개발 진행 과정을 ‘recruiting’(환자모집) ‘suspended participant recruitment’(환자 모집 유예)으로 변경하면서 임상 중단 의혹이 제기됐다. 독성이나 이상반응 발견으로 개발 중단 수순을 밟는 것 아니냐는 의심이다.
약물의 안전성이나 효능과 관련된 문제가 아니라는 점에서 한미약품 입장에서는 최악의 상황을 모면한 것은 분명해 보인다. 한미약품은 베링거인겔하임이 ‘올무티닙’의 권리를 반환할 당시에도 '부작용 의약품 누명'을 쓰며 곤혹을 치렀다.
한미약품 측은 “현재 진행 중인 글로벌 임상을 차질 없이 이어갈 수 있도록 생산을 최적화하는 과정에서 이 같은 이슈가 발생했다”고 설명했다. 그러나 ‘생산 지연’에 대한 구체적인 이유는 밝히지 않은 상태다. 생산지연을 단순히 경미한 문제로 덮고 넘어가기엔 의혹이 모두 해소되지 않았다.
얀센이 임상시험을 진행 중인 제품은 한미약품이 보유한 약효지속 기반기술 랩스커버리(LAPSCOVERY)를 적용한 바이오의약품이다. 한미약품의 핵심 기반기술로 평가받는 랩스커버리는 바이오의약품의 짧은 반감기를 늘려주는 플랫폼 기술로 투여 횟수 및 투여량을 감소시켜 부작용은 줄이고 효능은 개선하는 기술이다. 약물의 체내 지속성을 증대시키기 위해 부착하는 단백질 ‘랩스캐리어’를 바이오 의약품에 화학적으로 결합하면 적은 용량으로도 약효를 최대 1개월까지 유지시키는 방식이다.
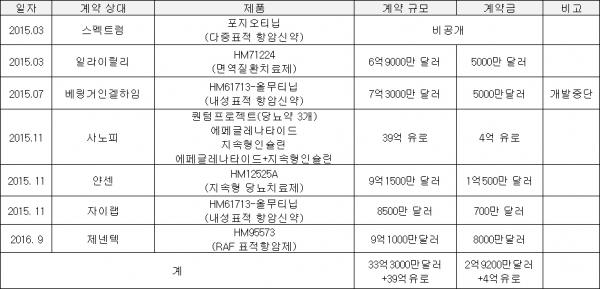
한미약품이 체결한 기술 수출 중 '랩스커버리' 관련 약물이 계약 규모가 가장 크다. 사노피와 체결한 총 39억유로 규모의 퀀텀프로젝트(당뇨약 3종)도 랩스커버리 적용 약물이다.
지난해부터 한미약품이 성사시킨 기술 수출 계약 규모는 약 9조원(33억3800만달러+39억유로)에 육박하는데 이중 랩스커버리 적용 약물은 60%가 넘는 약 6조원(9억1500만달러+39억유로)에 달한다. 한미약품이 확보한 계약금 약 8500억원(2억9200만달러+4억유로) 중 랩스커버리 관련 약물은 약 6200억원(1억500만달러+4억유로)으로 73%를 차지한다.
랩스커버리에 대한 시장에서의 기대감이 그만큼 크다는 방증이다. 하지만 공교롭게도 랩스커버리 기술 접목 약물 모두 생산 지연 문제로 임상시험이 지연되고 있다.
한미약품이 임상 2상시험을 마치고 사노피에 기술 수출한 당뇨신약 ‘에페글레나타이드’의 경우 연내 임상3상진입이 계획됐지만 한미약품의 생산 일정이 지연되면서 내년 초로 미뤄진 상태다.
업계에서 “랩스커버리 적용 약물의 생산 능력이 안정적인 단계에 도달하지 못한 것 아니냐”는 의혹이 나오는 배경이다. 실제로 랩스커버리 적용 약물은 제조과정은 다른 의약품에 비해 매우 복잡한 것으로 전해졌다. 임상시험을 통해 드러난 약물의 가치는 연이어 ‘빅딜’을 성사시킬 정도로 우수하지만 실제 공급을 위한 생산시설은 별도의 검증작업을 거쳐야 한다는 지적이다.
한미약품의 바이오의약품은 평택 바이오플랜트에서 생산된다. 지난 4월에는 1440억원을 투입해 2공장 건설에 착수했다. 글로벌 임상시험용 의약품을 공급하기 위한 공장이다. 벌써부터 임상시험을 지연시킬 정도로 제품 공급이 원활하게 진행되지 않는다는 사실은 한미약품 입장에서 고민이 아닐 수 없다.
최근 한미약품의 바이오플랜트 2공장 건설을 진두지휘하던 최모 상무가 돌연 사임하고 녹십자로 자리를 옮기자 업계에서는 공장 건설 과정에서 심각한 결함이 발생한 것 아니냐는 의혹이 확산되기도 했다.

사실 실험실에서 만든 시약과 똑같은 제품을 공장에서 대량 생산하는 것은 쉬운 작업은 아니다. 업계 한 관계자는 "설계도가 있다고 누구나 건물을 건설할 수 있는 것은 아니다"면서 "실험실에서 만든 시약을 대규모 공장에서 구현하는 것은 별도의 문제다"고 지적했다. 더욱이 바이오의약품은 화학의약품보다는 화학구조가 복잡해 생산 난이도가 월등히 높다.
한미약품이 빠른 시일내 안정적으로 제품을 생산할 수 있는 제조시설을 구축한다면 이번 생산지연은 단순 해프닝으로 끝날 공산이 크다.
그러나 반대의 경우 치명적인 문제에 노출된다. 생산 지연은 거래 상대방의 신뢰도 하락과 직결된다. 업계 한 관계자는 “신약 기술을 사들인 입장에서 임상시험용 제품 공급 문제로 임상시험 일정에 차질을 빚는 상황이 발생하면 신뢰가 하락할 수 밖에 없다”고 꼬집었다.
특히 임상시험용 제품 공급에 생산 관련 문제를 완벽하게 해결하지 않으면 향후 상업화 이후 대량 생산 단계에서도 또 다시 유사 문제를 노출할 가능성이 크다. 한미약품은 지난 3월 중국 연태시 경제개발구 지역에 약 20만㎡(6만여평) 규모의 토지를 매입했는데, 향후 기술수출 신약이 상업화 단계에 진입하면 중국에 생산기지를 구축하겠다는 구상이다.
◇모든 의약품 안정적 제조시설 입증해야 허가 가능
사실 의약품의 허가에서 ‘제조시설의 안정적인 생산 능력’이 차지하는 비중은 크다.
보건당국은 신약 등을 허가할 때 크게 ‘안전성ㆍ유효성’과 ' 제조ㆍ품질관리기준(GMP, Good Manufacturing Practice)' 2개의 영역을 점검한다. 임상시험 등을 통해 효능과 안전성을 살펴보고, 별도로 제조시설을 점검한다. 이때 상업적 생산을 진행할 때 매번 동일한 품질을 공급할 능력이 있는지를 따져본다. 아무리 뛰어난 약물이라도 안정적으로 생산할 능력을 입증하지 못하면 허가받을 수 없다.
제조공정의 허가를 받으려면 원칙적으로 실제 판매용 생산 분량을 3번 만들고 해당 제품들의 품질과 제조공정이 균일하다는 사실을 입증해야 한다. 1개 제조단위 또는 1배치(batch)라고 불리는 한번 생산 분량은 최소 10만정에 이른다. 최소 30만개를 생산한 이후 결함이 발생하지 않았다는 생산 능력을 검증받아야 시판을 허용해준다는 의미다.
같은 의약품이라도 제조시설이 변경되면 기존 약과 새로운 제조시설에서 생산한 제품이 동등하다는 사실을 입증해야 판매가 가능하다. 똑같은 약이라도 생산 장소가 다르면 최종 제품도 다르다는 원칙에서다.
결국 한미약품의 경우 바이오플랜트 1ㆍ2 공장, 상업용 제품 생산 대규모 공장에서 생산하는 제품의 품질이 일치해야 하는 ‘안정적인 제조시설 구축’이라는 숙제가 해결해야만 초대형 기술수출 계약이 완성되는 셈이다.
한미약품 관계자는 “현재 안정적으로 제품을 공급할 수 있도록 조치가 진행 중이다. 조만간 안정적인 공급이 이뤄질 것으로 예상한다”고 말했다.











![[정치대학] 美 대선, 막판까지 초박빙…당선자별 韓 영향은?](https://img.etoday.co.kr/crop/320/200/2098110.jpg)