미국선 리콜 주장까지 제기...식약처, "원료제조소 조사 결과 후 국내 유통 395개 품목 조사 결정"
위장약 ‘잔탁’의 발암유발 물질 검출 우려가 자칫 커질 모양새다. 국내 1차 조사에서는 일단 안전한 것으로 확인됐지만, 다국적 제약사가 글로벌 유통을 중단하고 미국에서는 리콜 주장도 제기되는 등 사태가 확산하고 있다.
19일 외신에 따르면 다국적 제약사 노바티스의 자회사 산도스는 미국을 비롯한 전 세계에서 잔탁의 제네릭 의약품 유통을 중단했다. 잔탁의 주성분인 라니티딘에서 N-니트로소디메틸아민(NDMA)이 검출된 데 따른 조치다. 라니티딘은 위산과다, 속 쓰림, 위·십이지장궤양, 역류성식도염 등에 사용하는 의약품이다. 노바티스는 내부 조사를 진행하는 한편 산도스의 라니티딘 함유 제품에 대해 명확한 결론이 날 때까지 유통을 중단할 예정이다.
앞서 미국 식품의약국(FDA)은 14일 라니티딘에서 발암유발 물질인 NDMA를 발견했다고 발표했다. FDA와 유럽의약품청(FDA) 등 각국 규제기관은 추가 조사에 착수했다.
NDMA는 세계보건기구(WHO) 국제 암연구소(IARC)가 사람에게 암을 일으킬 가능성이 있다고 판단한 물질이다. 지난해 7월 발사르탄 성분 고혈압약에서 검출되면서 국내에 널리 알려졌다.
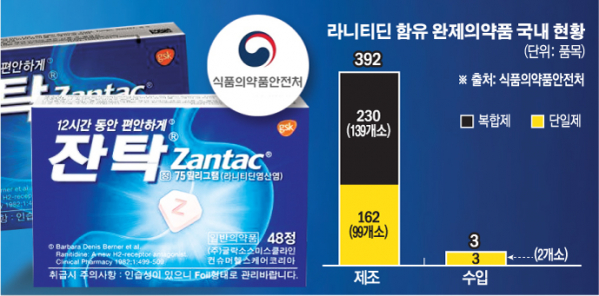
FDA의 소식을 접한 식약처는 한국 글락소스미스클라인(GSK)을 통해 국내 유통된 잔탁 제품과 잔탁에 사용한 원료제조소에서 생산된 라니티딘을 검사한 결과 NDMA가 검출되지 않았다고 16일 밝혔다. 이에 따라 식약처는 발사르탄 사태 때와 달리 판매 중지나 회수 등의 조치를 취하지 않았다. 대신 국내 허가·등록된 라니티딘 원료 제조소 11곳 중 긴급 조사한 1곳을 제외한 10곳에 대해 추가 조사를 진행 중이다. 결과가 나오기까지는 2주가량 소요된다.
FDA는 환자들에게 잔탁을 비롯한 라니티딘 의약품의 복용 중단을 권유하지 않았지만, 일부 국가는 발빠른 대처에 들어갔다. 캐나다 보건부는 라니티딘 제품 판매 기업들에 NDMA가 허용 가능한 수준을 초과하지 않았다는 증거가 나올 때까지 추가 유통을 중단할 것을 요청했다. 잔탁의 제조사 사노피는 캐나다에서 제품 유통을 중단했다. 싱가포르 보건당국은 라니티딘 의약품의 판매를 중단했다.
이런 가운데 미국에서는 FDA를 상대로 라니티딘 의약품에 대한 리콜 주장이 제기됐다. 미국의 온라인 약국 겸 연구소 밸리슈어는 FDA의 공식 NDMA 검사법으로 실험한 결과 FDA가 검출한 수준보다 훨씬 과도한 수준의 NDMA를 발견하고 라니티딘을 함유한 모든 제품의 리콜 및 판매 중단을 청원했다. 밸리슈어는 라니티딘과 NDMA의 연관성을 발견하고 이미 6월 FDA에 최초 연구 결과를 통보한 곳이다.
국내 위장병(소화성궤양) 치료제 시장은 약 1조511억 원(지난해 수입·생산실적 기준)이며, 이 중 라니티딘 함유 의약품은 2664억 원으로 4분의 1(25.3%)에 해당한다. 이는 발사르탄 성분 고혈압치료제 시장(약 2900억 원)과 비슷한 규모로, 발사르탄 사태처럼 악화할 경우 일대 혼란이 불가피하다.
식약처 관계자는 “어디까지나 민간 연구소의 권고이기 때문에 FDA의 공식 발표를 기반으로 대응하고 있다”면서 “발사르탄 때와 마찬가지로 원료 제조원 조사가 중요하기 때문에 최대한 신속히 결론을 내고 국내 유통 중인 395개 품목의 조사를 결정할 것”이라고 설명했다.
한국 GSK는 이달 말께 잔탁에 대한 자체 조사 결과가 나올 때까지 잔탁의 국내 유통을 일시 중단했다. 다만 이미 유통된 제품은 판매된다.











![[찐코노미] 테슬라, 진정한 성장 시작되나…국내 자율주행 기술 수준은?](https://img.etoday.co.kr/crop/320/200/2098264.jpg)