"사노피의 당뇨 신약 권리반환은 일방적 결정…바이오신약 파이프라인 개발 지속할 것"
사노피로부터 당뇨 신약 ‘에페글레나타이드’의 권리 반환을 통보받은 한미약품이 바이오신약 파이프라인 개발을 지속하겠다고 강조했다.
한미약품은 사노피가 에페글레나타이드의 권리를 반환하겠다는 의향을 통보해 계약에 따라 120일 간의 협의 후 이를 최종 확정한다고 14일 공시했다.
이와 관련 한미약품은 “에페글레나이타드의 유효성, 안전성과는 무관한 사노피의 일방적 결정일 뿐”이라며 “NASH(비알코올성 지방간염), 비만, 희귀의약품 등 분야에서의 혁신신약 개발은 흔들림 없이 진행되고 있다”고 밝혔다.
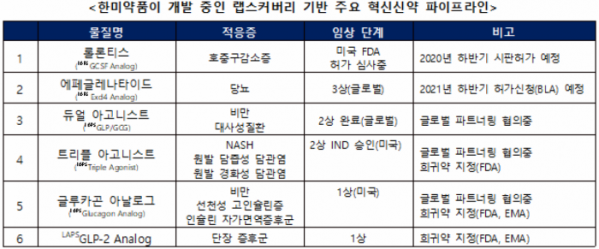
한미약품은 이번 사노피의 권리 반환 의향과 별개로 현재 진행중인 랩스커버리 기반의 다양한 바이오신약 개발을 차질 없이 진행해 나갈 계획이다. 현재 30여 개에 이르는 신약 파이프라인을 확보해 글로벌 상용화를 위한 개발 중이며, 이 중 바이오의약품의 약효를 늘려주는 플랫폼 기술 랩스커버리 기반의 다양한 바이오신약 후보물질을 확보하고 있다.
이 가운데 랩스커버리가 적용된 호중구감소증치료 바이오신약 ‘롤론티스’는 작년 말 미국 식품의약국(FDA)에 시판허가를 신청해 올해 하반기 출시가 예정돼 있다. 한미약품은 롤론티스의 국내 허가도 최근 신청했다.
비만치료제 ‘듀얼 아고니스트’는 약물 재창출을 통한 새로운 적응증 치료제로 개발하고 있다.
혁신 NASH 치료제로 개발중인 글루카곤/GIP/GLP-1 삼중작용제 ‘트리플 아고니스트’는 단일 타겟 경구 치료제의 한계를 극복할 수 있는 신기전 치료제로 주목받고 있다. 트리플 아고니스트는 지난해 미국 FDA로부터 원발 경화성 담관염과 원발 담즙성 담관염 치료를 위한 희귀의약품으로 각각 지정됐다.
한미약품이 1상 임상을 진행중인 ‘글루카곤 아날로그’는 미국 FDA와 유럽의약품청(EMA)로부터 선천성고인슐린증 희귀약으로 지정된데 이어, 지난달 말 EMA로부터 인슐린자가면역증후군치료를 위한 희귀의약품으로 추가 지정됐다. 현재 랩스커버리가 적용된 바이오신약 중 FDA, EMA 희귀약 지정은 8건에 이른다.
랩스커버리가 적용된 이들 파이프라인 다수는 현재 글로벌 제약기업들과 파트너링을 협의 중이라고 회사 측은 설명했다.
한미약품 관계자는 “여러 건의 반환 사례가 있었지만 한미약품은 여전히 로슈의 제넨텍, 스펙트럼, 아테넥스 등 경쟁력 있는 글로벌 기업들과 함께 신약 개발에 매진하고 있다”고 말했다.











![[정치대학] 美 대선, 막판까지 초박빙…당선자별 韓 영향은?](https://img.etoday.co.kr/crop/320/200/2098110.jpg)