당뇨병성 신경병증 임상 3상서 유효성 입증 못해

새로운 최대주주 체제에서 도약을 노리던 헬릭스미스가 유전자 치료제로 개발 중인 엔젠시스(VM202)의 당뇨병성 신경병증(DPN) 임상 3상에 실패하면서 또다시 악재를 만났다. 회사는 이번 결과를 토대로 향후 임상과 투자전략을 수정할 계획이다.
3일 헬릭스미스는 미국에서 진행한 엔젠시스의 DPN 임상 3상의 톱라인 분석 결과 주평가지표를 달성하지 못했다고 밝혔다. 회사 측에 따르면 주평가지표인 일평균 통증수치(ADPS)에서 엔젠시스 투약군이 위약군 대비 유효성을 입증하지 못했다.
헬릭스미스 관계자는 “임상 3상을 마친 후 초기 분석에서 주평가지수를 달성하지 못했다”며 “향후 최소 2개월간 2차 지표, 탐색 지표, 서브 그룹에 대한 분석을 할 예정”이라고 말했다.
저조한 임상 결과로 헬릭스미스의 계획에도 차질이 생겼다. 회사는 지난해 12월 세포치료제 기업 바이오솔루션과 총 365억 원 규모의 제3자배정 유상증자를 통해 경영권 양수도 계약을 체결했다. 앞서 카나리아바이오엠으로부터 자금을 수혈하고 최대주주를 넘겼지만, 유상증자 납입이 제때 이뤄지지 않은 탓이다.
최대주주도 기존 카나리아바이오엠에서 바이오솔루션으로 바뀌었다. 이에 따라 헬릭스미스의 지분은 최대주주인 바이오솔루션이 15.2%, 카나리바이오엠이 7.9%, 창업주 김선영 부회장이 4% 보유 중이다.
바이오솔루션은 최대주주에 오를 당시 헬릭스미스의 주요 파이프라인 대부분을 유지하고 파트너십을 통해 각사의 기존 포트폴리오에서 시너지 효과를 내는 과제를 개발해 연구 및 사업을 확대해 나간다고 밝혔다. 그러나 이번 결과로 향후 임상 계획에 변화가 생길 전망이다.
헬릭스미스는 우선순위로 미국 임상 단계에 있는 족부궤양으로 선회하겠다는 방침이다. 앞서 회사는 미국에서 족부궤양 임상 3상에 도전했지만, 환자 모집 난항을 이유로 조기 종료한 바 있다. 중국에서는 임상 3상을 마치고 분석 중이며, 올해 해당 임상 결과를 발표할 예정이다.
헬릭스미스 관계자는 “중국에서 임상 3상 중인 중증하지허혈은 궤양과 통증으로 나눠 진행 중이다. 그중 궤양에 대해서는 3상을 마치고 분석 중"이라며 "결과가 좋게 나오면 미국에서도 임상을 추진할 가능성이 크다. 임상 시기는 올해 예산과 상황을 고려해 바이오솔루션과 상의해 결정할 것”이라고 말했다.
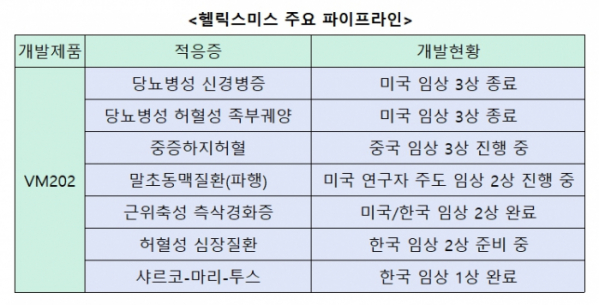
이외에도 주요 파이프라인인 VM202를 중심으로 임상과 투자전략에 변화를 줄 예정이다. 현재 VM202은 당뇨병성 신경병증뿐 아니라 당뇨병성 허혈성 족부궤양 △중증하지허혈 △말초동맥질환(파행) △근위축성 측삭경화증 △허혈성 심장질환 △샤르코-마리-투스를 적응증으로 개발 중이다.
헬릭스미스는 파이프라인 정리로 재무구조 개선을 기대하고 있다. DPN 임상이 중단되면 미국 임상 비용이 감소해 현금 지출이 줄어들 것이라는 계산이다.
최대주주인 바이오솔루션 관계자는 “헬릭스미스에 투자할 때 엔젠시스 DPN 임상의 성공 여부는 고려 대상이 아니었다”며 “이번 결과로 ‘헬릭스미스는 엔젠시스 DPN’이라는 이미지가 사라지면서 회사의 불확실성이 제거되고, 재무구조가 개선돼 다른 사업을 확대 발전시킬 수 있는 계기가 될 것”이라 밝혔다.











![[컬처콕 플러스] 아일릿, 논란 딛고 다시 직진할 수 있을까?](https://img.etoday.co.kr/crop/320/200/2095915.jpg)