WHO에 신약 등재…공적원조시장 겨냥
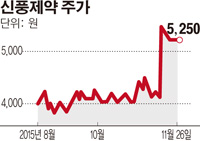
[종목돋보기] 신풍제약이 소아용 말라리아 치료제 ‘피라맥스과립’의 제품등록을 32개 국가에 추진한다. 이 약은 최근 유럽약정국(EMA)으로부터 신약 허가 승인을 받았다.
26일 신풍제약은 “말라리아 치료제 수요가 높은 아프리카 25개국을 비롯해 미얀마, 라오스, 캄보디아, 베트남, 태국을 포함한 동남아 7개국 등 총 32개 국가에 피라맥스과립의 제품등록을 추진하고 있다”며 “등록은 각국 규정에 따라 다르지만 짧게는 1년에서 평균 2년 정도 시간이 걸릴 것으로 예상한다”고 밝혔다.
신풍제약은 제품 등록 후 판매를 본격적으로 시작할 계획이다. 다만, 국가마다 제품 프로모션과 마케팅을 하기에는 어려움이 있기 때문에 글로벌 펀드와 같은 공적 자금을 통한 공적원조시장을 겨냥할 계획이다. 특히 신풍제약의 피라맥스과립은 WHO(세계보건기구)에 제품이 등재돼 있어 공적 시장 공략이 수월할 것으로 보인다. WHO는 결핵, 에이즈, 말라리아와 같은 3대 소외질환과 관련해 등록된 신약의 품질을 보장하고 있다.
피라맥스는 안산 제3공장에서 만들어진다. 신풍제약은 피라맥스 생산을 위해 EU-GMP인증을 받은 피라맥스 전용 공장을 준공했다. GMP는 우수의약품의 제조ㆍ관리 기준을 말한다.
피라맥스과립은 20kg 미만의 유·소아를 대상으로 열대열 말라리아원충과 삼일열 말라리아 원충에 의해 발생하는 말라리아의 치료에 모두 사용할 수 있는 ACT(Artemisinin Combination Therapy)계열의 소아용 말라리아 치료제다. 신풍제약과 WHO, 말라리아의약재단(MMV)이 공동으로 개발한 제품이다. 신풍제약은 MMV의 자금지원으로 연구비의 부담은 줄이면서 WHO를 통한 시장확충에 유리한 형태로 신약을 개발해 왔다.
말라리아는 세계적으로 한 해 100만명 가까운 사망자를 내고 있다. 특히 아프리카와 아시아 등의 국가에서 많은 환자가 발생하는 데다 사망 비중도 높다. 기존의 발매 중인 항말라리아제 약물은 내성발현으로 환자 치료에 한계가 있었지만, 피라맥스는 약물내성을 극복한 치료제로 복용 후 약효물질이 장기간 혈액에 남아 치료 후 재발 및 재감염을 줄여줄 수 있다.
신풍제약 관계자는 “신풍제약은 피라맥스정에 이은 피라맥스과립의 EMA 신약등록 성공으로 성인과 유소아용 말라리아 치료제 모두를 글로벌 신약으로 보유하게 됐다”면서 “한 환자가 1년에 최대 13회까지 감염이 발생하는 말라리아 감염률이 높은 지역에서 탁월한 효과를 보일 것으로 전망된다”고 말했다.
☞ 투자자 300명에게 공개하는 종목의 속살 이투데이 스탁프리미엄에서 확인하세요











![1300원부터 5000원까지…아메리카노 얼마가 적당할까 [데이터클립]](https://img.etoday.co.kr/crop/320/200/2098627.jpg)