식품의약품안전처는 부작용 보고건수가 증가한 프레가발린 등 4개 성분 209품목에 대한 일부 이상반응을 사용상의 주의사항에 추가하는 안전조치를 시행한다고 15일 밝혔다.
이번 조치는 이들 의약품을 사용하는 의료진과 환자에게 이상반응 발생과 증상 등에 대한 정보를 사전에 알려 주의해 사용할 것을 안내하려는 의도다.
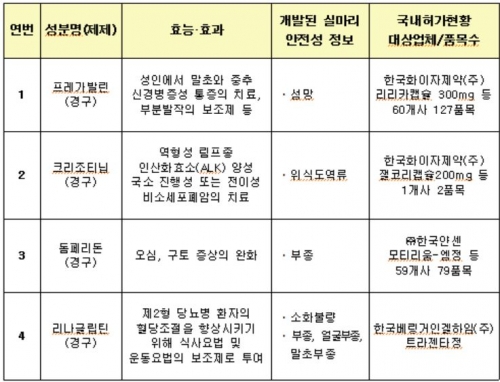
실제 사용상의 주의사항에 추가되는 주요 이상 반응은 △프레가발린 섬망(의식이 흐리고 착각과 망상을 일으키며 헛소리나 잠꼬대 등을 하는 증상) △크리조티닙 위식도역류 △돔페리돈 전신 부종 △리나클립틴 소화불량, 전신ㆍ얼굴ㆍ말초부종 발생 등이다.
부분발작의 보조제 등에 먹는 약으로 사용되는 프레가발린은 국내에서 한국화이자제약 리리가캡슐 300mg 등 60개사 127품목이 시판됐고, 비소세포폐암 등에 사용되는 크리조티닙은 한국화이자제약 잴코리캡슐 200mg 등 1개사 2품목이 나와있다.
오심, 구토 증상의 완화에 사용되는 돔페리돈은 한국얀센의 모타리움-엠정 등 59사 79품목이 있으며, 제2형 당뇨병 환자의 혈당조절을 향상시키기 위한 약물로 쓰이는 리나글립틴은 한국베링거인겔하임 트라젠타정 1품목이 판매 중이다.
식약처의 이번 조치는 1989년부터 2014년까지 국내서 자발적으로 보고된 의약품 부작용 정보에 대해 한국의약품안전관리원이 분석한 ‘실마리 정보’를 바탕으로 중앙약사심의위원회의 자문을 거쳤다. 실마리 정보란 자발적인 의약품 부작용 발생 보고를 축적해 의약품과 부작용 사이의 인과관계 가능성을 배제할 수 없어 지속적인 관찰이 요구되는 정보를 말한다.
식약처는 이번 허가사항 변경이 국민의 안전한 의약품 사용에 도움이 될 것이며, 앞으로도 부작용 사례를 지속적으로 점검해 필요한 안전조치를 시행하겠다고 밝혔다.










![[정치대학] 美 대선, 막판까지 초박빙…당선자별 韓 영향은?](https://img.etoday.co.kr/crop/320/200/2098110.jpg)