보령제약 관계사 바이젠셀은 자체 개발 중인 면역항암제 ‘VT-EBV-N’이 식품의약품안전처 개발단계 희귀의약품으로 지정됐다고 4일 밝혔다.
이에 따라 바이젠셀은 현재 진행 중인 ‘VT-EBV-201’(개발명)의 임상 2상이 끝나는 대로 신속 허가신청이 가능하다.
VT-EBV-201은 희귀 난치성 질환이자 혈액암의 일종인 EBV(엡스타인 바 바이러스)양성 NK/T세포 림프종 환자 중 관해 후 재발 고위험군 환자의 완전 치유를 목적으로 미세잔존암을 제거하기 위한 치료제로 개발되고 있다. 2017년 임상시험계획(IND)을 승인 받았다.
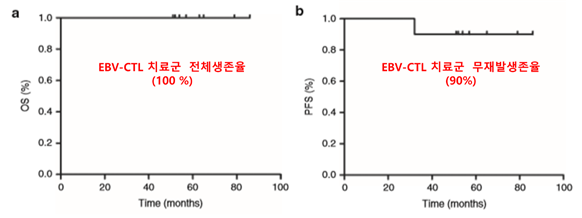
앞서 VT-EBV-201은 연구자주도임상 결과가 국제학술지에 소개되면서 주목받은 바 있다. 2015년 5월 미국 유전자세포치료학회 공식저널 몰레큘러 테라피에 발표한 논문에 따르면, 항암치료 및 자가이식을 받은 NK/T세포 림프종 환자 11명에게 VT-EBV-201를 투여한 결과 11명의 환자가 모두 생존해 전체 생존율 100%, 5년 무병 생존률이 90 %에 달하는 것으로 나타났다. 모든 환자를 5년 이상 장기추적조사한 결과다.
NK·T세포 림프종은 희귀난치성 질환으로, 표준치료법이 없으며 2년 이내 재발률이 75%에 이르는 암이다. 재발됐을 때는 치료법이 없어 상당수가 사망한다. 기존 화학합성 암 치료제로 치료했을 때 2년 생존율은 약 26%에 불과하다.
일반적으로 EBV는 동양인의 경우 인구의 약 90%가 감염돼 있으며, 정상인에서는 암을 유발하지 않지만 면역체계가 손상되어 있을 경우 잠복하던 바이러스가 활성화해 암을 유발한다. EBV와 같은 바이러스에 감염된 종양세포의 완전사멸을 위해서는 CTLs(특이적인 세포독성 T세포) 반응이 필수적이다. EBV 연관 종양인 NK/T세포 림프종은 한국인 비호지킨 림프종의 약 6.3 %에 해당하며 아시아권에서 많이 발생한다.
회사 관계자는 “VT-EBV-201이 상용화되면 재발 가능성이 높은 환자에게 치료의 기회를 제공할 뿐 아니라 더 나아가 완치까지 가능 할 수 있을 것으로 기대된다”고 말했다.
바이젠셀은 VT-EBV-201 다음 파이프라인으로 급성골수성백혈병 치료제 ‘VT-Tri-A’를 준비하고 있다. 연내 식약처에 IND를 승인받고 상업화 임상에 진입하는 것이 목표다.











![요즘 가요계선 '역주행'이 대세?…윤수일 '아파트'→키오프 '이글루'까지 [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2099221.jpg)